Τί είναι ο ασβέστης ;
Ο ασβέστης είναι μία από τις πέντε περισσότερο χρησιμοποιούμενες χημικές ενώσεις στον κόσμο και παράλληλα είναι το φθηνότερο και περισσότερο χρησιμοποιούμενο, άλκαλι. Αν και η αναφορά του ονόματος, παραπέμπει στις πάσης φύσεως κατασκευαστικές εφαρμογές, εν τούτοις στις ανεπτυγμένες χώρες, η χρησιμοποίηση του σε άλλες βιομηχανικές δραστηριότητες, απορροφά το μεγαλύτερο ποσοστό (80-85%) των χρήσεών του. Στην Ελλάδα, η εικόνα είναι αντίστροφη, με αποτέλεσμαένα μικρότερο ποσοσοτό των χρήσεών του να απορροφάται από τις εκτός των δομικών, εφαρμογές [1].
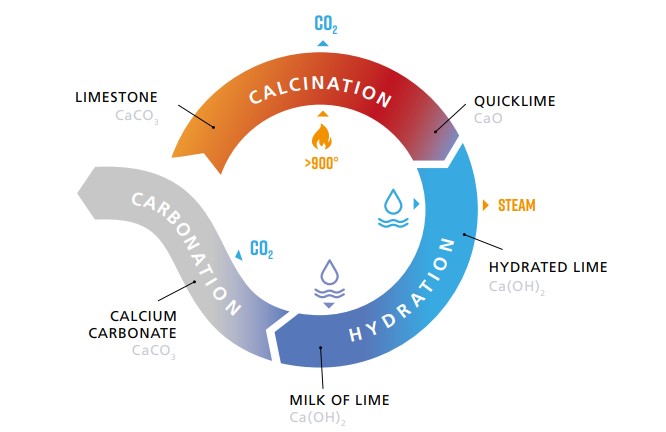
Ο όρος "άσβεστος" αποτελεί συμβατική ονομασία των προϊόντων της πύρωσης και της μετέπειτα κατεργασίας ανθρακικών πετρωμάτων όπως ασβεστόλιθοι, δολομίτες και μάρμαρα. Χρησιμοποιείται κυρίως για να περιγράψει το οξείδιο του ασβεστίου, ή άνυδρη άσβεστος (CaO), που προκύπτει από τη θερμική διάσπαση σε θερμοκρασίες πάνω από τους 900 °C ανθρακικών πετρωμάτων, υψηλής περιεκτικότητας σε ανθρακικό ασβέστιο (συνήθως πάνω από 97%). Σε αυτό το χαρακτηριστικό στηρίζεται η βιομηχανία της άσβεστου, χρησιμοποιώντας τη διεργασία που γενικά είναι γνωστή ως «ασβεστοποίηση» (calcination). Η μετατροπή του ανθρακικού ασβεστίου που συμβαίνει κατά την ασβεστοποίηση περιγράφεται από την ακόλουθη χημική αντίδραση:
CaCΟ3 + θερμότητα
-> CaO + CΟ2 (1)
Η άσβεστος αντιδρά ραγδαία με το νερό, απελευθερώνοντας θερμότητα και δίνει υδράσβεστο,
[Ca(OH)2]. Η ενυδάτωση της ασβέστου είναι μια αμφίδρομη αντίδραση που περιγράφεται από την
ακόλουθη χημική εξίσωση:
CaO + H2O <-> Ca (OH)2 + θερμότητα (2)
Υπάρχουν ωστόσο και οι μορφές της ασβέστου που προκύπτουν από την κατεργασία δολομιτικών ασβεστολίθων. Αυτές περιλαμβάνουν τη δολομιτική άσβεστο (CaO•MgO), την δολομιτική υδράσβεστο τύπου Ν [Ca(OH)2•MgO] και S [Ca(OH)2•Mg(OH)2] [2].
Η υδράσβεστος (υδροξείδιο του ασβεστίου)
μετατρέπεται φυσικά ξανά σε ανθρακικό ασβέστιο (CaCO3) αντιδρώντας
με το διοξείδιο του άνθρακα (CO2) που προέρχεται είτε από τον αέρα, είτε
από το νερό της βροχής. Η μετατροπή αυτή ονομάζεται ενανθράκωση (carbonation) και
περιγράφεται από την χημική εξίσωση:
Ca(OH)2 +
CO2 -> CaCO3 + H2O (3)
Στην ενανθράκωση αποδίδεται και η σκλήρυνσή του ασβέστη, μια ιδιότητα η οποία τον καθιστά κατάλληλο για δομική χρήση.
Ολόκληρη η διαδικασία – αλληλουχία 3
αντιδράσεων (1), (2), (3) – αναπαρίσταται σχηματικά στο παραπάνω γράφημα και ονομάζεται κύκλος του
ασβέστη (Lime cycle).
Βιβλιογραφία:
1. Τσίμας Σ., Επιστήμη και Τεχνολογία Ασβέστη, ΕΜΠ, 2007
2. Τριανταφύλλου Γ. και Μανούτσογλου Ε., Η Συμβολή της Ασβέστου στην επίλυση περιβαλλοντικών προβλημάτων, Δελτίο της Ελληνικής Γεωλογικής Εταιρίας τομ. XXXVI, 2004, Πρακτικά 10ου Διεθνούς Συνεδρίου, Θεσ/νίκη Απρίλιος 2004